硫酸亞鐵投加量影響電鍍廢水
電鍍廢水因為其成份復雜,含有眾多重金屬離子如:銅、鎘、鉻、鋅等,并且還含有如酸 、堿、氰化物等具有毒性的物質在里面。而對于電鍍廢水的處理方法目前我國多采用“鐵氧體法”處理。而鐵氧體法的主要投加藥劑亞鐵鹽就包括硫酸亞鐵,并且硫酸亞鐵的投加量直接影著鐵氧體法效果與去除率,今天我們主要通過實驗來研究硫酸亞鐵的投加量的多少對其廢水處理效果的影響有多少。以及如何確定硫酸亞鐵的投加量。
、堿、氰化物等具有毒性的物質在里面。而對于電鍍廢水的處理方法目前我國多采用“鐵氧體法”處理。而鐵氧體法的主要投加藥劑亞鐵鹽就包括硫酸亞鐵,并且硫酸亞鐵的投加量直接影著鐵氧體法效果與去除率,今天我們主要通過實驗來研究硫酸亞鐵的投加量的多少對其廢水處理效果的影響有多少。以及如何確定硫酸亞鐵的投加量。
我們實驗以電鍍廢水中的含鉻廢水為案例進行實驗,通過實驗我們發現。鉻酐濃度在100mg/L 時,其 CrO3∶FeSO4•7H2O=1∶16~18;有的工廠用1∶20~30;也有的采用1∶80,所以硫酸亞鐵的投加量差別很大。在處理含鉻、鎳、銅、鋅等混合離子電鍍廢水時,對硫酸亞鐵投加量也有不同看法。一種認為以處理廢水中所含各種離子最佳投藥量的疊加數作為總投加量,另一種認為以處理廢水 中Cr6+離子的投加量來計算總投加量。實踐證明,硫酸亞鐵投量過少,廢水中就會有殘留的金屬離子需脫除;投藥量過大,不但增加了廢水處理費用,還會使水中鹽分過多,則出水色度 加大,影響水質。因此、硫酸亞鐵投加量的準確程度,是能否達到處理效果 的關鍵。
鐵氧體法處理電鍍廢水的基本原理及硫酸亞鐵投加量的依據
用鐵氧體法處理重金屬離子電鍍廢水,就是向廢水中加入一 定量的Fe2+和 Fe3+離子。在溫度大于7O度和pH值一定的溶液中,使Fe(OH)2適量氧化生成Fe3O4,即
Fe(OH)2+O2=2Fe3O4+6H2O (1)
Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O (2)
廢水中的Cu2+、Ni2+、Ni2+、Cr3+等離子進行下列反應:
xM2++(3-x)Fe2++6(OH)--MxFe(3-x)(OH)6 (3)
(x代表二價金屬的離子數)
(3)式的產物在特定條件下,又被新氧化溶解,最終可按(4)式反應,生成尖晶石型的鐵氧體重結晶。
MxFe(3-x)(OH)6+1/2O2----- MxFe(3-x)(OH)4+3H2O (4)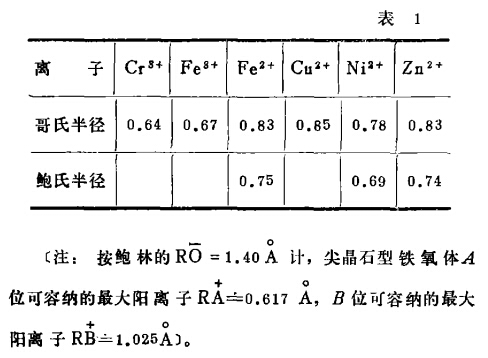
根據尖晶石型鐵氧體A位和B位空間的大小、溶于廢水中的Cu2+、Ni2+、Ni2+、Cr3+ 離子半徑(見表1)和其它條件,這些離子都能按上述方式進入晶體,形成晶石型的復合鐵氧體一起共沉,從而達到凈水的目的。
用鐵氧體法處理電鍍廢水的關鍵是廢水中必須有足夠的鐵離子;而一般廢水中的鐵離子含量卻遠遠不能滿足,因此需要外加補充。因為廢水中離子的成分和嘗試不穩定,若分開配加Fe2+和Fe3+離子,卻不經濟也不方便,所以一般都是加Fe2+離子,讓Fe2+離子通過不同的氧化方式形成Fe3+離子再來平衡溶液中的二價、三價鐵離子數。從而滿足在形成鐵鐵體過程中對Fe2+離子和Fe3+離子的需求。
二價鐵離子的來源比較廣如鋼鐵廠的酸洗廢液,欽白廠的廢料以及利用廢鐵屑加廢硫酸來制取均可。
關于二價鐵離子投加量的多少,要看廢水中的金屬離子能與鐵離子形成什么樣的晶體(不同晶體其分子式不同 ),再根據晶體分子式來計算所需鐵的最低量。例如處理含Pb2+離子的廢水,因為Pb2+離子的半徑為1.32A,不能形成尖晶石型,只能形成磁鉛石型晶體,其分子式為:PbFe12O9。即一摩爾離子的Pb2+需要12摩爾離子的Fe2+。處理鍍鋅、鎳、銅單一離子廢水時,Cu2+、Ni2+、Ni2都可以生成尖晶石型的單一鐵氧體,即鋅鐵氧體、鎳鐵氧體和銅鐵氧體。從它的的分子式可以看出1摩爾離子的鋅、鎳、銅需2摩爾離子的三價鐵。
因此用鐵氧體法處理含鋅、鎳、銅這幾種離子的廢水時,亞鐵離子(Fe2+)投加量的理論計算為:亞鐵離子摩爾數:預處理二價金屬離子摩爾數為2:1。
若二價鐵以FeSO4•7H2O表示,則硫酸亞鐵投加量與金屬離子重量之比為:
2×FeSO4•7H2O/Zn2+=2×227.95/65.38≈8.5
2×FeSO4•7H2O/Ni2+=2×227.95/58.7≈9.5
2×FeSO4•7H2O/Cu2+=2×227.95/63.54≈8.7
本文章來源由硫酸亞鐵廠家原創,轉載請注明地址:http://m.awcw.cn/xnews/214.html





